国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 14 医药医疗器械行业报告
吸入制剂的疗效取决于肺部的沉积量,较理想的颗粒直径为1-5μm。吸入制剂粒子大小在肺部沉降中扮演着重要的角色。若粒子直径小于 1μm,有很高的成分比例被呼出;介于1-5μm时可以达到肺的周边;大于5μm以上时,粒子沉降的位置就会从肺的周边移至传导性气道中; 超过10μm,则沉积于口咽的比例就会增多;10-15μm的粒子容易沉降于鼻腔和咽部。 不同装置类型药物沉积于肺中的比率不尽相同,大部分的气雾吸入系统沉积于肺中的比率约为1-50%。药物沉积量取决于装置类型、病人本 身、药物种类、疾病类型等,除了沉积在肺部以外,会有口咽损失,装置残留损失,和呼气/环境损失等。如Albuterol在pMDI加压定量吸入器 两个喷雾计量200微克药物中,约有20-40微克到达肺部,其余部分在口咽、设备、周围环境中或随呼出的气体排出。 相同药物的不同吸入装置正确使用时具有临床效果等效性。不同的装置不仅肺部沉积不同,肺部给药的名义剂量也不同,但是《chest》期刊 上证明按照正确的使用方法,临床效果等同。以支气管扩张剂Ipratropium为例,SVN的名义剂量较高为0.5mg,而pMDI仅需0.04mg,SVN小 容量喷雾器的名义剂量比pMDI压力定量吸入器多约12倍,按要求使用pMDI或SVN上标示的剂量,可以达到相同的临床效果。
单独使用经典药动学研究不足以评价吸入制剂的生物等效性。局部作用的吸入制剂给药后,首先在呼吸道发挥作用,然后 才进入全身血液循环。如沙美特罗替卡松粉雾剂,吸入后作用于支气管和肺部,而后通过肺泡吸收进入到血液循环中。给 药后在靶组织中的浓度与血药浓度是不同步的,其药动学和效应/毒性器官暴露量之间缺乏相关性,经典药动学研究在吸入 制剂上确实有局限性,需要建立一套新的体系来评估这些吸入仿制药的生物等效性。 美国FDA和欧盟EMA等效性评价标准不同。为了开发安全有效的药物,美国FDA 于20世纪90年代中期提出了集合证据加权 法( weight-of-evidence approach) 来综合评价吸入制剂的全身吸收量和效应 /毒性器官生物等效性,主要包括 :①体外研究; ②药动学研究;③药效学或临床终点研究。FDA 已明确要求首先采用群体生物等效性方法进行体外研究,结合药动学指标 和临床终点指标共同评价仿制制剂的安全性和有效性,吸入仿制药的BE具体是处方和装置相似、体外试验相同、全身暴露 等同以及PD/临床疗效等同等四项全部满足要求后才能确定最终的生物等效性。欧盟EMA要求相对宽松,生物等效性BE通 过条件更多。在体外等同的情况下,不需要做太多的验证试验,只需要满足药学等同或全身暴露等同或PD安全性等同其中 一项就可以确定BE。相信随着装置研究的不断进步,吸入给药的长期安全及生物等效评价会更加完善。

标签: 医药医疗器械行业报告
相关文章
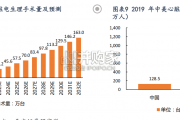
国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 14 医药医疗器械行业报告
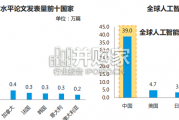
近年来,国内关于人工智能领域的研究十分密集,发文量激增。目前,中国不论在高水平论文还是专利申请数量上都位居世界前列,视觉、语 音、自然语言处理等基础智...
2024-03-07 31 医药医疗器械行业报告

RSV疫苗上市后表现亮眼。据GSK的财报,AREXVY上市后首个季度2023Q3的销售额达7.09亿英镑(约8.5亿美元)全年销售额达12.38亿英镑...
2024-03-05 22 医药医疗器械行业报告
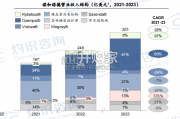
口服胰岛素可更好地模拟人体内胰岛素自然 生理分泌。 正常情况下,胰岛素由胰岛 β 细胞分泌, 经门静脉直接进入肝脏,人体分泌的胰 岛素80%进入肝脏与...
2024-03-04 30 医药医疗器械行业报告
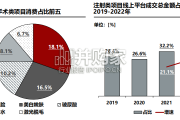
根据2022年新氧医美行业白皮书,2022年非手术类项目消费占比前五的分别是除皱瘦脸、美白嫩肤、玻尿酸、保湿补水和激光脱毛,其中除皱瘦脸和美白嫩肤项目...
2024-03-03 42 医药医疗器械行业报告
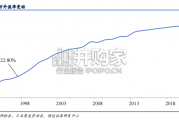
1978 年前,我国医院的所有投资和开销都来自于政府财政,医院主要专注于医疗服务。1978 年改革开放后,国 家财政拨款仅提供医院开支的 10%左右,...
2024-03-02 39 医药医疗器械行业报告
最新留言