大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 20 医药医疗器械行业报告
BioNtech、Moderna三期临床期中数据保护率分别为94.5%、95%,二者均获得了FDA授予的快速通道 认定,预计将于年底前向美国FDA申请“紧急使用许可”(Emergency Use Authorization,EUA)。 BioNtech-BNT162b2(预设感染人数164人*)。BioNtech与Pfizer联合开发的新冠疫苗三期临床期中结果 良好,有效性超过95%,疫苗安全性好。 有效性(95%):截止目前,在43,538名志愿者中共有170例感染(已超过预设感染人数),其中有10例 重症患者,9名来自于对照组,1人来自于疫苗接种组。 安全性:在试验中未发生严重不良反应,疫苗安全性较好。 申报预期:为加速研发进度,尽快得到可靠数据,公司计划当感染人数分别达到62人、92人及120人时, 进行3次期中分析。目前总感染人数已达预设目标,故当前数据可用于EUA申请。 Moderna-mRNA-1273(预设感染人数151人*)。Moderna三期期中临床实验结果积极且超出预期,有效 性高达94.5%,暂时未观察到安全性问题。 有效性(94.5%):截至披露时间,有95名参与者确诊感染新冠病毒(尚不足预设感染人数要求),其 中有90人来自于对照组,5人来自于疫苗接种组;其中重度患者11名,全部来自于对照组。 安全性:目前观察到的安全性问题多为注射部位酸痛,乏力、发烧、关节/肌肉酸痛,且大多1到2天内消 失;未观察到严重副作用。
群体免疫(Herd Immunity),区别于个体免疫,不仅仅是整个群体中免疫个体数的简单加和,还暗含 了免疫个体数达到一定水平后对于非免疫个体的间接保护(indirect protection of nonimmune persons)。 直接免疫保护既可以来源于传染病感染,也可以来源于疫苗接种,而疫苗接种正是现代群体免疫提升的 重要手段之一,也是终结疫情、根除传染病的主要方式之一。 根据简化的流行病学离散模型,某感染期(t+1)内的新患数(Ct+1)应为前一感染期内的新患数(Ct)、 易感人群数(St)与传播系数(Transmission Parameter,r)的乘积,而传播系数与病原体自身特性及群 体社会行为直接相关。我国在新冠防疫中的成功经验正是通过物理隔离的方式来降低传播系数。

标签: 医药医疗器械行业报告
相关文章

大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 20 医药医疗器械行业报告
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 29 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 35 医药医疗器械行业报告
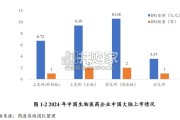
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 33 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 22 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 26 医药医疗器械行业报告
最新留言