复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 20 医药医疗器械行业报告
2020年国内血制品批签量总量达9827.37万,同比增长16.68%,其中人血白蛋白5891.24万(+19.04%)、免疫球蛋 白类3434.08万(+9.32%)、凝血因子类502.05万(+51.19%)。整体来看,2020年白蛋白依旧占据国内血制品行业 主导地位,凝血因子类在低基数的情况下增速最快。静丙被纳入新冠诊疗指南,需要有望得到释放。2月14日,国家卫健委NCP重型、危重型病例诊疗方案(试行 第二版)首次将 IVIG(静注人免疫球蛋白)列入诊疗方案,此举在一定程度上使医生开始重视静丙的临床功效,提高医生与患者对静丙的认可 程度,进而有望推动其国内适应症范围的扩大,国内静丙的需求有望得到释放。 云南拟新增浆站20家,新设浆站限制或有望得以放宽。云南省卫健委于2020年12月发布《云南省单采血浆站设置规划(2020— 2023)(征求意见稿)》,拟在全省设置单采血浆站24家(在4家试点的基础上新增20家),目前已有天坛旗下上海血制的2家 浆站在云南试点运营,累计采浆量约42吨。云南或将是十四五时期国内放宽新设浆站数量限制的开端,其他省份开设浆站的规 划有待后续跟踪。
GMP配套《血液制品》附录修订版颁布并落地,生产及监管要求严格化,检疫期缩短至60天。2020年7月1日药监局发布了《药 品生产质量管理规范》血液制品附录修订稿,新版附录对血制品的原料采集、生产、监管要求进一步严格化,检疫期由原先的3 个月调整为60天,新版附录已于2020年10月1日起正式施行。《生物制品批签发管理办法》公布,规范生物制品批签发行为,加强批签发风险管理。2020年12月11日,国家市场监督管理总 局公布《生物制品批签发管理办法》,新办法落实了新制修订《药品管理法》和《疫苗管理法》的要求,全面规范批签发行为, 厘清批签发主体责任,加强批签发风险管理,该办法将自2021年3月1日起正式施行。

标签: 医药医疗器械行业报告
相关文章
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 20 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 26 医药医疗器械行业报告
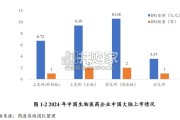
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 24 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 18 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 24 医药医疗器械行业报告

MG 为神经肌肉接头传递障碍诱发的自免类疾病,生物制剂打开治疗新格局 重症肌无力(Myasthenia Gravis, MG)是一种由神经肌肉接头(N...
2025-04-16 19 医药医疗器械行业报告
最新留言