复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 14 医药医疗器械行业报告
中国政府积极推动细胞治疗产品转化。 海外已批准10余种干细胞产品;中国政府的积极推进将加速干细胞临床应 用及产品转化进程,现累计已有11款干细胞产品获得临床批件,成都蓉生 静注巨细胞病毒人免疫球蛋白已进入III期临床进展最快。 全球获FDA批准上市的CAR-T产品有5个,有亮眼市场表现;中国尚未有 CAR-T产品获批上市,进展最快的两款产品已申报上市,对标海外产品的 成长轨迹,前景广阔 细胞治疗产业链有高成长性。 从上游而言,中国细胞治疗产业链处于探索状态,但医药外包服务一体化 兴起、国产CAR-T疗法获批在即、中国细胞治疗开发试验数量增加,细胞 治疗产业链有高成长性。从中下游而言,中国双轨制允许医疗机构在经伦理委员会批准后免费开展 细胞治疗临床试验,作为诊疗手段,在政策监管趋严的背景下行业将更加 规范发展 攻克实体瘤成为差异化发展关键。实体瘤的研究占比逐年降低,2021年占比39.8%,但是拥有90.2%的市场空 间,将成为细胞治疗企业未来差异化发展的战略方向之一。产品研发、市场和商业化途径对未来的细胞治疗商业化 具有重大的影响,因此如何发现与借鉴商业模式,并且 如何更为精准地针对血液瘤与实体瘤等疾病将成为评估 市场潜力的重要因素。
国产产品的顺利上市将推动中国细胞治疗市场规模上升。 至2021年6月,中国有三款国产CAR-T产品处于上市申 请阶段,其中两款在国内申请(药明巨诺瑞基伦赛、复 星凯特阿基伦赛),另外一款在美国申请(传奇生物西 达基奥仑赛)。 预计于2021年至2025年,中国细胞治疗市场规模(以 成本价计)将由人民币13亿元升至人民币162亿元,复 合年增长率为87.9%。未来伴随更多的细胞治疗产品获 批,市场预计于2030年达人民币584亿元,2025年至 2030年的复合年增长率为29.2%。海外已批准10余种干细胞产品;中国政府的积极推进将加速干细胞临床应 用及产品转化进程,现累计已有11款干细胞产品获得临床批件,成都蓉生 静注巨细胞病毒人免疫球蛋白已进入III期临床进展最快。全球获FDA批准上市的CAR-T产品有5个,有亮眼市场表现;中国尚未有 CAR-T产品获批上市,进展最快的两款产品已申报上市,对标海外产品的 成长轨迹,前景广阔 。TCR-T在实体瘤疗效较好,虽因毒性短暂停滞但已从最开始的基础免疫研 究走进临床应用,未来将逐渐往高效、低毒及可操控的通用型方向发展。

标签: 医药医疗器械行业报告
相关文章
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 14 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 24 医药医疗器械行业报告
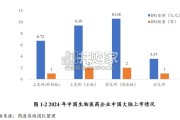
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 21 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 15 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 23 医药医疗器械行业报告

MG 为神经肌肉接头传递障碍诱发的自免类疾病,生物制剂打开治疗新格局 重症肌无力(Myasthenia Gravis, MG)是一种由神经肌肉接头(N...
2025-04-16 19 医药医疗器械行业报告
最新留言