大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 12 医药医疗器械行业报告
生物标志物通常是指能被客观测量和评价,反映生理或病理过程,以及对暴露或 治疗干预措施产生生物学效应的指标。其来源于人体组织或体液,可涵盖生理、生化、 免疫、细胞和分子等水平的改变。在肿瘤领域,生物标志物通常是由肿瘤细胞或非肿 瘤细胞产生的、反映体内肿瘤细胞或非肿瘤细胞存在和变化的生物学物质。 生物标志物的检测可广泛地应用与病人的筛查、诊断、临床研究、指导用药、预 后等领域。根据功能的不同,生物标志物可分为6类。同一生物标志物可能具有不同功 能属性,因此在不同的应用背景下,同一生物标志物具有不止一种分类。例如BCR-ABL1 融合基因是CML的诊断性生物标志物,BCR-ABL1激酶区的突变情况同时也可预测患者对 不同BCR-ABL1抑制剂的治疗反应,因此也是预测性生物标志物。携带罕见突变的癌症患者缺乏有效的靶向药,存在巨大的未满足临床需求。肿瘤 药临床设计和适应症申请/审批通常是依照肿瘤的组织起源,如肺癌、胃癌、肝癌等, 靶向药通常需要进行多个临床试验以及上市申请。药企倾向于做患者多入组快,且潜 在的市场规模巨大的适应症,通常是带有常见突变的大癌种,如EGFR突变的肺癌、HER2 突变的乳腺癌等。
而对于罕见突变,如在中国肺癌患者中不足0.1%的NTRK融合突变, 由于入组难和市场小,药企的研发动力不足,临床推进缓慢。FDA大力支持篮式临床方案+使用替代临床终点,加速了泛癌种适应症的批准。篮 式临床设计入组了多种适应症,在样本量一定的情况下,具体各适应症的实际入组患 者非常有限,有些适应症样本量甚至只有个位数。在此背景下,同意将携带同一突变/ 生物标志物的患者视为一个整体,根据整体患者的临床数据,批准涵盖同一突变/生物 标志物的全部实体瘤适应症需要监管机构的认可和支持。2018年9月,美国食品和药物 管理局(FDA)发布了指导文件草案,概述了对篮式试验和伞式试验的建议,并强调支持 更广泛地使用这些方案的临床试验。2009年到2019年,美国篮式临床数量从1项增加至 49项。加之2012年后FDA同意使用替代临床终点来进行加速重大疾病药物的批准,泛癌 种适应症最终得以获批上市。 截止至2021年11月,FDA共批准3个泛癌种适应症。分别是高度微卫星不稳定/错配 修复缺陷(MSI-H/dMMR)实体瘤、高肿瘤突变负担(TMB-H)实体瘤、携带NTRK融合突 变实体瘤。

标签: 医药医疗器械行业报告
相关文章

大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 12 医药医疗器械行业报告
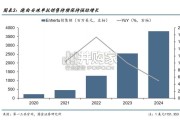
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 27 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 32 医药医疗器械行业报告
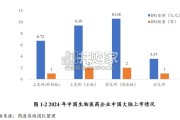
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 31 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 21 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 25 医药医疗器械行业报告
最新留言