大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 7 医药医疗器械行业报告
美国同样将医疗器械分为三类。第Ⅰ类为“普通管理”产品——危险性小或基本无 危险,例如医用手套、压舌板、手动手术器械、温度计等。第Ⅱ类为“性能标准管 理”产品——具有一定危险性的产品,例如心电图仪、超声诊断仪、输血输液器具、 呼吸器等。第Ⅲ类为用于支持或维持生命、对保护人类健康起至关重要的作用, 或存在导致病痛或伤害的潜在、过度风险的产品,例如人工心脏瓣膜、心脏起搏 器、人工晶体、人工血管等。 虽然 FDA 与 CFDA 都将医疗器械分为Ⅰ、Ⅱ、Ⅲ类,但具体的器械分类目录有 所不同。FDA 主要是依据风险等级来进行分类,而 CFDA 在依据风险等级的同时, 也会注重医疗器械的功能、临床使用和管理难度。总的来说,FDA 更侧重于产品 本身的危险性,而 CFDA 则更关注产品管理的难易程度。比如输血输液器具,FDA 认为器具本身的危险性并不高,因此归于 II 类,而 CFDA 认为,输血输液器具会 直接侵入人体,若是不严格管理输血输液器具的使用,可能会对人体造成极大危 害,例如一器多用有造成血友病,艾滋病,或是误输药剂等风险。造成这一不同 的根本原因,是 FDA 在为器械分类时,默认要求该器械处于一般控制之下,即默 认按照基本管理规范来使用器械,而 CFDA 则考虑到管理不当的风险。
FDA 总部共由生物制品评价研究中心(CBER)、器械和放射产品健康中心 (CDRH)、药物评价研究中心(CDER)等部门组成。除血源筛查的医疗器械由 生物制品评价研究中心(CBER)负责管理外,其余的医疗器械产品均由器械和 放射产品健康中心(CDRH)负责管理。 看上去中美审查流程相差不大,然而在实际申请中会发现差异还是非常明显的。 总体来说,FDA 宽进严出,CFDA 严进宽出。相比 FDA,CFDA 在审批流程上会 非常严格。自 2015 年 7 月 22 日,CFDA 发布《关于开展药物临床试验数据自查 核查工作的公告》(2015 年第 117 号)以来,曾经存在的大量临床试验数据造假 现象急剧减少。CFDA 希望中国的医疗行业能够重视临床基础数据的重要性,高 标准研发,规范生产。

标签: 医药医疗器械行业报告
相关文章

大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 7 医药医疗器械行业报告
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 22 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 28 医药医疗器械行业报告
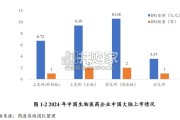
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 29 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 20 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 25 医药医疗器械行业报告
最新留言