大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 19 医药医疗器械行业报告
根据 PDB 数据库的样本数据,2012-2020 年样本医院注射剂销量同比增速与入院人数增 速高度相关,2012-2019 年注射剂销量 CAGR+2.4%,保持低速增长。2020 年受疫情影 响,20Q1 注射剂销量创单季度低点, 20Q2-Q4 同比均负增长但降幅逐季度收窄,21Q1 销量同比增长 21.5%,呈现快速恢复。由于注射剂 2020 年 5 月开始被纳入一致性评价, 在第四批和第五批国家集采中分别有 8 个/32 个注射剂产品被纳入。随着入院人数和终端药品需求的增长,我国药包材行业市场规模呈现稳定增长,其中药用 玻璃市场规模总体震荡攀升。根据中玻网统计,我国药用玻璃行业市场规模从 2012 年约 175 亿元增长到 2020 年的 234 亿元,CAGR+3.7%。自 2015 年中国药用玻璃市场突破 200 亿元后,持续稳定在 200 亿以上,2020 年药用玻璃市场规模 234 亿元,同比+2.6%。 我们预计随着注射剂纳入一致性评价和疫情影响逐渐消除,药用玻璃市场有望加快增长。
药品一致性评价和关联审批是推动药用玻璃包材行业升级的核心动力,药品集采加快助推。 从需求上看,药品一致性评价和关联审批两大政策本质上仍是为了提高药品安全性,而药 企为了顺利通过评价与审批,将使用中硼硅玻璃替换原有钠钙、低硼硅玻璃包材。从供给 上看,随着我国国内中硼硅玻璃技术的突破和生产的量产,我国国产中硼硅玻璃有望打破 外资企业的垄断,以更优的价格和质量实现国产药用玻璃的渗透提升。 仿制药一致性评价目的是对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则, 进行质量一致性评价,即仿制药需在质量与药效上达到与原研药一致的水平。2017 年 12 月我国颁布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,指出注射剂 使用的直接接触药品的包装材料和容器应符合总局颁布的包材标准,不建议使用低硼硅玻 璃和钠钙玻璃,该政策有助于推动药用玻璃向中硼硅玻璃替换升级。注射剂是目前化学仿制药中的重要组成部分,推动进行一致性评价有望加快拉动国内中硼 硅玻璃的需求。自 2020 年 5 月注射剂被正式纳入一致性评价以来,我国注射剂申请通过 一致性评价的品种和品规数量快速增加。截至 2021 年 7 月末,过去 15 个月我国累计通过 注射剂一致性评价 118 个品种、248 个品规。

标签: 医药医疗器械行业报告
相关文章

大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 19 医药医疗器械行业报告
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 29 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 35 医药医疗器械行业报告
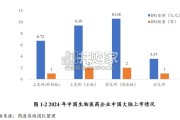
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 33 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 22 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 26 医药医疗器械行业报告
最新留言