大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 7 医药医疗器械行业报告
目前,mRNA三巨头的LNP技术都来自“3A”(Arbutus、Acuitas和Arcturus)的直接或二次授权。Acuitas于2012年得到 Arbutus授权,后二次授权给Moderna,2016年Arbutus对Acuitas展开诉讼并于2018年达成和解,Acuitas不再使用和对外授 权所涉LNP专利,同年Moderna发起针对Arbutus的069专利(US8058069)在内的三项专利诉讼,2020年美国专利复审委员 会(PTAB)维持069专利有效。现阶段LNP依然是mRNA成药的最关键因素,企业研发布局也大多集中在高通量筛选阳离子脂质, 除非对脂质设计进行革新,否则很难突破专利壁垒。mRNA-LNP的制剂工艺在实验室(microfluid)和工业生产(T-junction mixing)场景相似,其基本原理均为溶 解在乙醇中的脂类与溶解在水相中的mRNA溶液快速混合后,在压强和pH值变化中mRNA分子和可电离脂质自组 装形成纳米颗粒。在这一过程中可以通过控制水相和脂相流速、mRNA与脂类比例、PEG-lipid含量等条件从而改 变终产物的形态和大小。RNA作为一类全新药物形态的设想始于1990s,最初的十余年里,mRNA被认为过于不稳定且高纯度体外合成成本高昂, 大企业大多浅尝辄止(Merck短暂评估mRNA流感疫苗后转投DNA疫苗和其他载体介导的递送系统)。随着序列优化、分 子修饰、体外RNA合成、递送系统和脂质体封装等关键技术逐步突破,以两款新冠mRNA疫苗获批为标志,mRNA药物 正式走向台前。
同时,围绕着这些关键技术也形成了相应的专利和工艺技术壁垒。传统疫苗依靠细胞培养(鸡胚或哺乳动物细胞),研发和生产过程复杂,通常可长达数月;mRNA疫苗根据病毒序列设计优化,由 DNA模板体外合成,研发和生产更快,例如Moderna的新冠mRNA疫苗从获得病毒到生产出临床样品仅需42天,经过优化后 Pfizer/BioNTech的生产流程可以控制在一周以内。 免疫原性更强 mRNA疫苗在人体自身细胞内直接表达抗原蛋白,胞内和分泌蛋白分别通过组织相容性抗原复合物(MHC)I型和II型分子呈递,同时 激活CD8+和CD4+T细胞,通过激活细胞毒性T细胞分泌细胞因子、B细胞产生中和抗体以及激活吞噬细胞等方式清除病原体。同时, mRNA和LNP脂类也能通过“自佐剂”效应进一步增强免疫原性,从而提升疫苗的保护效力。肿瘤免疫疗法(IO,Immune Oncology)主要通过抗体(免疫检查点PD-(L)1/CTLA-4)或细胞治疗(CAR-T)实现 免疫检查点抑制剂(CPI,Checkpoint Inhibitor):检查点抑制剂单药的应答率偏低(只在抗原表位数量高的肿瘤如 Melanoma有效率较高),部分患者难以受益,需要联用其他疗法加强对肿瘤的识别/杀伤能力 CAR-T等细胞疗法:识别/杀伤能力强,但会被肿瘤微环境抑制,导致T细胞增殖/治疗能力下降(e.g.BioNTech的 CARVac平台);肿瘤细胞在突变作用下肿瘤抗原完全消失或低水平表达,产生免疫逃逸(BioNTech的NEOSTIM平 台)。

标签: 医药医疗器械行业报告
相关文章

大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 7 医药医疗器械行业报告
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 23 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 28 医药医疗器械行业报告
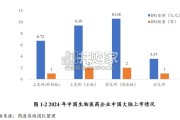
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 29 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 20 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 25 医药医疗器械行业报告
最新留言