大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 12 医药医疗器械行业报告
从 2022 年上半年看,国家药品监督管理局药品审评中心共受理了 135 个细胞治疗产品 的各类申请。其中绝大部分为试验性新药(IND)申请(包括 8 项补充申请),仅有 3 个为上市申请(目前已获批 2 个)。在这 135 个申请中,70 个为 CAR-T,25 个为其他 类型的免疫细胞治疗,31个为间充质干细胞,间充质干细胞数量仅次于风口上的CAR-T。 在 132 个临床申请中(包括近期受理、尚在审评中的品种),共有 88 个获批临床。而在 CDE 受理的干细胞治疗产品数量中,2017 年无申报,随着政策的松动,2018 年、 2019 年、2020 年均为 4 项,2021 年增长为 10 项,截至 2022 年 11 月上旬,本年干细胞治疗产品的受理达 29 项,近两年呈现出较快的增长趋势,主要由于技术转化的 推进,政策的明朗及扶持以及资本的支持。2021 年,人羊膜上皮干细胞注射液首次受理,2022 年 2 月 11 日,国家药品监督管理 局药品审评中心(CDE)正式审批通过“人羊膜上皮干细胞注射液治疗造血干细胞移植 后激素耐药型急性移植物抗宿主病”1 类新药临床试验的申请。 2022 年,间充质干细胞仍然占据主要份额,受理达 26 项。目前干细胞的直接应用在临 床上有限。
临床阶段的通常绝大部分为间充质干细胞,主要作用有两大类,第一类是免 疫调控的作用,另一类是炎症应对。此外还有相对窄的应用,是下游分化的一些细胞类 型,如软骨细胞,脂肪细胞等修补类型。 同时前体细胞开始崭露头角,2 项前体细胞治疗产品获得受理,分别为“人源多巴胺能 前体细胞注射液 NouvNeu001”,以及“肺前体细胞(非干细胞)制剂 REGEND006”。 其中,睿健医药首款针对帕金森的细胞药物产品“人源多巴胺能前体细胞注射液” (NouvNeu001)现已进入中国 IND 补充研究阶段,并即将向美国 FDA 正式提交 IND 申请。华源再生医学、智新浩正等企业也在积极布局肾脏、胰脏再生赛道。华源再生医学目前 布局肾脏系列、胰脏系列、血管系列、生物制造与细胞制备的专用设备试剂耗材系列四 大板块。目前再生器官类产品都处于 IIT(含细胞)和 IND 前制备阶段;细胞产品在 IIT 启动期和大动物准备期。 智新浩正目前管线范围包括胰岛再生及肝脏再生等方向;利用再生胰岛移植治疗胰岛损 伤类糖尿的 IIT 于 2021 年 7 月完成了第一例,这也是世界上尝试通过自体细胞在体外 再造自体再生胰岛组织并用移植治疗的首次尝试;目前第一批 IIT 入组两例患者,分别 是糖尿病肾病肾脏移植后及脆性 1 型糖尿病类型,均属于胰岛移植的刚需患者;在组织 器官体外再造方面,已构建了具有完整的血管网络的肝、胰组织,可实现免疫细胞在血 管化人造组织中的灌流,可用于体外重现真实组织结构的免疫微环境、模拟疾病发生发 展、研究多器官互作及药物筛选。

标签: 医药医疗器械行业报告
相关文章

大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 12 医药医疗器械行业报告
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 27 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 32 医药医疗器械行业报告
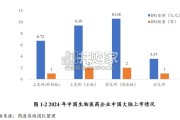
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 31 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 21 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 25 医药医疗器械行业报告
最新留言