国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 17 医药医疗器械行业报告
FDA 目前共批准 22 款生物类似物,其中只有 4 款抗体类生物类似药实现上市销售。 FDA 对于生物类似物的审批监管起步晚于 EMA,由于原研药企的强势,生物类似药 的批准速度也较慢,自 2010 年生物类似药简化申请途径设立后,直至 2015 年正式 批准第一个生物类似药 Zarxio 上市,目前共有 22 款药物获批,其中 5 个为重组蛋 白,其他 17 个位抗体类药物。尽管已有 22 款产品获批,但真正上市销售的目前 9 个药物,而单抗类似物仅 4 家,由于美国专利制度的原因,原研药企将通过各种途径 延长其专利有效期,并与厂商进行专利诉讼来限制其商业化进展。 EMA 目前已获批 57 款生物类似药,其中抗体类药物 30 款。从生物类似药上市进程 来看,EMA 的起步要远远早于 FDA,2006 年,首款重组人生长激素仿制药 Omnitrope 获批上市,其后,其他生物类似药也相继获批上市,但单抗类药物由于专利保护原因, 一直未有获批,直至 2013 年,Remicade 的类似药 Inflectra 和 Remsima 相继获批 上市,打开了单抗仿制药商业化之路,从审批数量来看,EMA 批准的单抗类生物类 似药远远高于 FDA。
美国市场生物类似药降价幅度较少,产品替代原研较慢。2016 年 11 月,Remicade 的首款生物类似药由辉瑞上市销售,其定价折扣为原研的 85%,之后降至 81%。2017 年 7 月,默沙东和三星 Bioepis 将第二个 Remicade 的生物类似药 Renflexis 定价为 原研的 63%,约 735 美元(100mg)。从定价来看,美国市场的生物类似药并不像化 学仿制药一样在价格上展开激烈的厮杀,同时从销售额数据来看,虽然增长速度较快, 对原研也产生了一定的替代作用,但总体来说替代进程缓慢。Remicade 的销售额下 降主要原因来自于 Humira 的竞争,生物类似药的规模体量较小,未对其产生明显竞 争。目前 Remicade 在北美的市占率约为 10%,2019 年有望达到 15%,但总体来说 替代率较慢。主要原因有两个: (1)价格上没有产生有力的竞争,价差并不足以使大量患者修改用药方案。 (2)这两款生物类似药均不具备“可替换性”,在医生处方时并不能自由替换原研产 品,因此产品仍需市场推广,影响了放量速度。
市场竞争加剧,生物类似药实际降幅迅速增大。欧洲地区对生物类似药的上市态度 较为积极,因此获批的产品数量迅速增加,在市场竞争下,降价也不可避免。以德 国地区为例,其上市销售的Infliximab和Rituximab分别有4个和3个厂商,Infliximab 原研价格在第二个类似药上市后迅速下降,三者实际降幅同时达到30%以上,而在 第三个生物类似药上市后,药品价格进一步下滑,降幅接近60%。Rituximab的生 物类似药价格降幅也分别在20%和30%左右。面对生物类似药在欧洲市场的来势汹 汹,原研厂商也不得不降价以保住份额,Humira的厂商AbbVie在18年10月中旬决 定降价80%。

标签: 医药医疗器械行业报告
相关文章
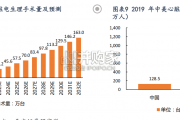
国内电生理渗透率更低,处于快速发展阶段。尽管国内过速性心律失常患者人数庞大,但受限于相关疾病早筛尚未推广、电生理手术难 度高等因素,电生理治疗渗透率仍...
2024-03-08 17 医药医疗器械行业报告
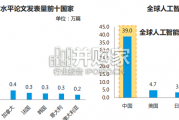
近年来,国内关于人工智能领域的研究十分密集,发文量激增。目前,中国不论在高水平论文还是专利申请数量上都位居世界前列,视觉、语 音、自然语言处理等基础智...
2024-03-07 31 医药医疗器械行业报告

RSV疫苗上市后表现亮眼。据GSK的财报,AREXVY上市后首个季度2023Q3的销售额达7.09亿英镑(约8.5亿美元)全年销售额达12.38亿英镑...
2024-03-05 22 医药医疗器械行业报告
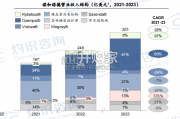
口服胰岛素可更好地模拟人体内胰岛素自然 生理分泌。 正常情况下,胰岛素由胰岛 β 细胞分泌, 经门静脉直接进入肝脏,人体分泌的胰 岛素80%进入肝脏与...
2024-03-04 30 医药医疗器械行业报告
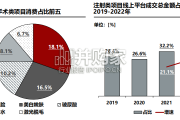
根据2022年新氧医美行业白皮书,2022年非手术类项目消费占比前五的分别是除皱瘦脸、美白嫩肤、玻尿酸、保湿补水和激光脱毛,其中除皱瘦脸和美白嫩肤项目...
2024-03-03 42 医药医疗器械行业报告
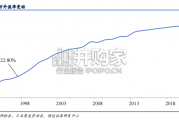
1978 年前,我国医院的所有投资和开销都来自于政府财政,医院主要专注于医疗服务。1978 年改革开放后,国 家财政拨款仅提供医院开支的 10%左右,...
2024-03-02 39 医药医疗器械行业报告
最新留言