复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 20 医药医疗器械行业报告
中美医疗支付能力差距显著,海外市场空间巨大。中国人口众多,医疗市场体量庞大,位列全球第二,仅次于美国。2017年,美 国总医疗费用支出是中国的4.4倍。但人均医疗费用远落后于美国,同年美国人均医疗费用支出是中国的18.8倍。尽管近年来中国 医疗行业发展迅速,与国际差距逐步缩小,但冰冻三尺非一日之寒,2021年中美医疗费用支出仍存在3.9倍的差距,人均医疗费 用仍有16.6倍的差距。 随着国内床新药研发实力的快速提升,药物创新性和研发效率的优势受到全球的认可,新药出海对于企业而言势在必行。但出海 本无须如此迫切,只是在带量采购、医保谈判、创新药内卷加剧等冲击下,国内创新药企业被迫寻找新的出路和发展空间。考虑 到太平洋彼岸的美国市场存在着巨大的市场空间和想象空间,国内企业争相将海外战略付诸实践,加速全球化进程。首个成功出海创新药泽布替尼美国商业化进展顺利,海外市场份额已超越国内市场份额。2021年,泽布替尼在美国市场实现7亿 元销售额,国内市场实现6亿元销售额,美国市场销售额超越国内市场,充分验证了全球市场的广阔潜力。 关键适应症有望于2023年1月获批,未来空间不容小觑。尽管泽布替尼在美国商业化进展顺利,但我们认为,泽布替尼距离峰值 销售额尚存在较大距离。
究其原因,在于核心适应症尚未获批。实际上,慢性淋巴细胞白血病/小细胞淋巴瘤(cLL/sLL)是BTK TKI的关键适应症,也是伊布替尼放量的关键。虽然泽布替尼在美国尚未获批cLL/sLL这一关键适应症,但我们欣喜地看到,4月 12日,经独立审查委员会确认,泽布替尼在复发或难治性(R/R) cLL/sLL患者中已展现出优于伊布替尼的总缓解率。考虑到泽布 替尼在与伊布替尼的头对头试验中胜出,我们认为,泽布替尼大概率通过FDA审批,获批上市。鉴于PDUFA日期预计为2023年1 月,这一时间点值得高度关注。我国创新药出海的四大趋势: (1)数量提升:IND数量急剧增加,出海候选药物数量快速攀升。自2015年药政改革启动,得益于药审改革的稳步推进 和医保谈判的宽准入,创新药IND申报数量随着激励政策的逐渐明朗迅速攀升,并在2017年出现了明显拐点。2021年,国 产化药和国产生物药IND数量均突破200例,创下新高。我们认为,随着国产创新药IND数量的提升,为药物出海提供了大 量候选药物,一批兼具疗效和安全性的药物有望扬帆起航,剑指海外。 (2)临床提速:核心临床数目超越美国,有望加速全球化进程。随着时间的推移,越来越多的国产创新药推进至关键临床, 逐渐步入收获期。在肿瘤领域,自2019年,国产创新药开展的核心临床数量已超过美国,并于2020年达到123项。我们认 为,临床试验数目超越美国标志着我国新药创制进展顺利,一方面,优异的早期临床数据有望吸引MNC入局,通过 License out推进海外临床开发进程;另一方面,创新药上市后的海外商业化授权有望加速企业全球化进程,突破利润天花 板,绿叶制药、复宏汉霖、百奥泰等已经示范。

标签: 医药医疗器械行业报告
相关文章
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 20 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 26 医药医疗器械行业报告
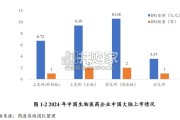
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 25 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 18 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 24 医药医疗器械行业报告

MG 为神经肌肉接头传递障碍诱发的自免类疾病,生物制剂打开治疗新格局 重症肌无力(Myasthenia Gravis, MG)是一种由神经肌肉接头(N...
2025-04-16 19 医药医疗器械行业报告
最新留言