大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 2 医药医疗器械行业报告
审批端:在视同通过一致性评价路径下,仿制药获批上市数量快速增长。目前 通过一致性评价有两种情况:(1)已上市的产品通过一致性评价研究(补充申请) 获得通过一致性评价称号;(2)按新注册分类(仿制药上市申请)获批后视同通过 一致性评价(视同路径),包括 3 类、4 类和 5.2 类的化药。近年来通过一致性评 价的仿制药数量逐渐稳定,2023 年有 815 个受理号通过一致性评价,同比增长 4.4%;按照新注册分类的仿制药获批数量快速增长,2023 年获批上市的仿制药达 到 1785 个,同比增长 83.6%。大部分品种有多家企业过评,“三年关门”制度下老批件过评工作将逐渐出清。 截至 2023 年底,通过一致性评价(含视同)的药品品规数达到 2119 个,涉及 1125 个品种。总体来看,36%的过评品种只有 1 家企业过评,有 48.2%的过评品 种的过评企业有 2-9 家,过评企业数超过 10 家的品种数量占比已经超过 15%。 其中,苯磺酸氨氯地平片是过评企业数最多的品种,高达 54 家;分剂型看,注射 剂由于 CMC 要求更高、一致性评价工作开展时间较晚等原因,过评企业的集中度 相对口服固体制剂更低。针对未过评的存量文号,CDE 明确在首家过评三年后将 不再受理其他相同品种的一致性申请,进一步加速老批件的一致性评价工作。一致性评价将从口服制剂和注射剂扩展到所有剂型,有望为 CRO 带来广阔的 市场空间。目前我国只有口服制剂和注射剂正式启动了一致性评价,而国家前九批 药品集中采购规定申报品种必须是通过一致性评价或者按照新注册分类获批上市 的仿制药,这意味着除口服制剂和注射剂之外的吸入制剂、滴眼液、外用制剂等其 他剂型中,只有按照新注册分类批准的品种有资格纳入集采,而老批件由于不能进 行一致性评价而无法参与集采。2023 年 9 月 25 日 CDE 发布了《仿制药质量和疗 效一致性评价受理审查指南(征求意见稿)》,明确了其他剂型一致性评价申报资料 的整理要求,说明所有剂型的老批文都可以启动一致性评价。剂型扩展将进一步扩 大一致性评价存量市场的规模,有望为仿制药 CRO 带来广阔的市场空间。

标签: 医药医疗器械行业报告
相关文章

大模型的推理能力和多模态能力持续升级、应用成本不断下降,驱动医疗机构加 速融合 AI 技术。根据 DataBridge 的测算,预计至 2031 年全...
2025-04-19 2 医药医疗器械行业报告
复盘目前增长:2024 自然年第一三共 HER2 ADC 德曲妥珠单抗在全球销售额合约 38 亿美 元,同比增长约 50%,德曲妥珠单抗强劲增长得益于...
2025-04-18 20 医药医疗器械行业报告

世界卫生组织提出“健康不仅是躯体没有疾病,还要具备心理健康、社会适应良好和有道德”。2025年,国民对健康的定义 除了身心健康、状态积极、作息规律之外...
2025-04-17 26 医药医疗器械行业报告
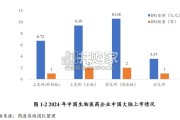
根据药渡数据库统计,在 2024 年中,总计 19 家中国生物医药公司在中国大陆、 香港和美国纳斯达克完成 IPO。其中 A 股上市 6 家(科创板上...
2025-04-17 25 医药医疗器械行业报告

在当今全球化竞争日益激烈与国内经济结构深刻转型的背景下,企业面临着前所未有的复杂外部环境。高 管作为企业战略实施与日常运营的核心驱动力,其团队的稳定与...
2025-04-17 18 医药医疗器械行业报告

2021 年,中美关节置换手术量差距仍然巨大,2021 年中国全髋关节置换 术共约 77 万例,全膝关节置换术共约 52 万例,而美国 2021 年全...
2025-04-16 24 医药医疗器械行业报告
最新留言